AIとはどういうものなのか、ということを今更わかりやすく説明する必要はないだろう。多くの方が知りたいのは「で、AIで何ができるの?」「私にも開発できるの?」「どうやったら市場に出せるの?」ということだろう。AIをニュースとして聞くだけでなく、実際にAIを活用して自分たちで何かを生み出してみたい、という人も増えているように思う。そして、一般的にはITの活用が遅れているイメージがある医療・ヘルスケア領域に、これを機に参入できるのではないかと考えている人が、私に尋ねてくることも増えてきている。最近では、医療AI、あるいはAIソフトウェア医療機器という言葉もよく聞かれるようになってきたが、AIソフトウェア医療機器の研究から販売までを見通した手引きのようなものは身近にない。創業したLPIXEL社においても様々な苦労を重ねてソフトウェア医療機器としてPMDAや認証機関から承認・認証を得ることができたが、これからAIソフトウェア医療事業に興味がある研究者、エンジニア、起業家、事業家のために、これまで学んできたことが少しでも参考になればと思い、ライトにまとめてみようと思う。
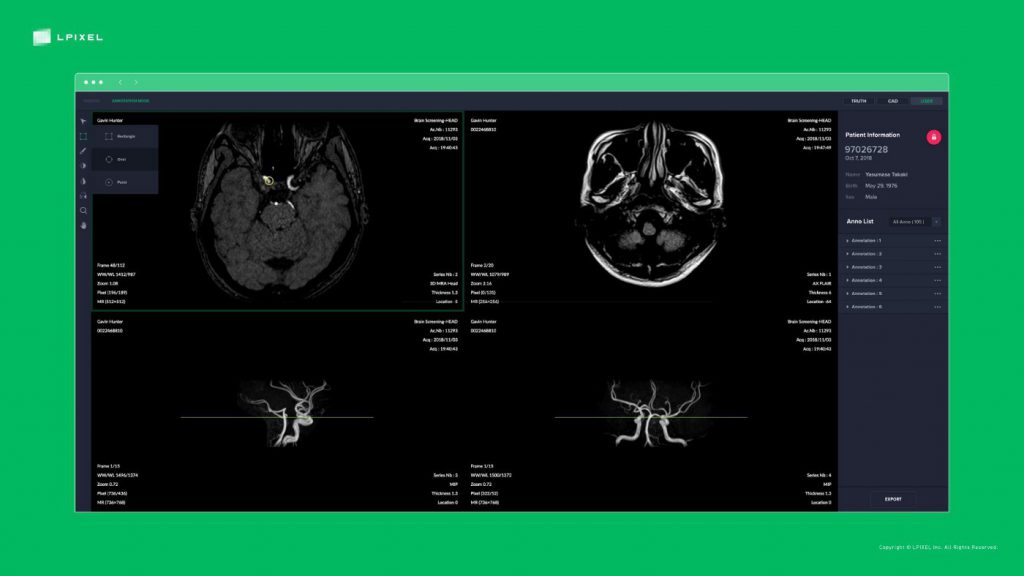
AIソフトウェア医療機器開発の4つステップ
2014年11月25日に施行された薬機法の改正により、医療診断支援のソフトウェアは単なるおまけではなく、医療機器して認証・承認を得ることが必要になった。ここでは単なる万歩計や心拍数を可視化をするようなへルスケアアプリではなく、医師の診断に一定以上影響を及ぼす、ソフトウェア医療機器を前提とする。ソフトウェア医療機器の開発には大きく(1)研究開発(2)製品開発(3)法規制対応(4)製品販売、の4つのステップがあるので、一つずつ簡単に説明しようと思う。
(1)研究開発
まずは何を開発することから決める。どんな課題を解決するのか、そしてそれはどれだけ嬉しいことなのか、当事者でない限り、医療従事者等と入念にディスカッションすることが必要である。事業化を検討しているのであれば、一般の人が思っている以上に医療は専門が細かく分かれているため、製品が開発されたとしたらどれくらい使われることになるのか、価格はいくらになりそうかなど、事業性について遠慮なく医療従事者等に聞いた方がいいだろう。研究教育機関が相手の場合は、論文を書くところまで興味がある場合もあれば、実際に製品として世の中に普及させることに興味がある場合があるので確認が必要である。また、企業からの資金よりも国家プロジェクト等の競争資金を一緒に取ることを好む先生もいる。研究を始めるにあたっては、win-winの協力が築けそうか確認することが重要である。いよいよ研究を開始するフェーズになれば、実現可能性を検証するため、PoCと呼ばれるような簡単な技術調査・検証をすることになる。実際に医療機関のデータを学習として活用する場合は、医療情報は法律上の要配慮個人情報に該当するため、取り扱いには十分気をつける必要がある。一般的には、研究計画書を作成し、医療機関側の倫理委員会を通してもらう必要があり、数ヶ月待つこともある。無事に通れば、ようやく研究開始である。慣れないと、最初の打ち合わせからここに来るまで半年経過していることもある。説明する過程で具体例がある方がイメージが湧きやすいと思うので、この記事では「肺のCT画像から肺がんの候補点をハイライトして医療画像診断を支援するAI(CADeとも呼ばれる)を開発すること」かつ「医療機器クラスⅡに該当すること」を例にしたいと思う。このような目的とした場合、肺がんのCT画像に、候補点となるところにアノテーションする作業を依頼をすることになる。しかし、どんな完璧な人間でもミスをするし、人により診断基準も異なる。いかにゴールドスタンダードをつくるかについては、多数の医師の意見が一致したものをゴールドスタンダードにしたり、病理診断などの確定診断の結果をゴールドスタンダートにすることなどが必要である。アノテーションの形式は四角くく囲むバウンディングボックスだけのこともあれば、領域部分を1ピクセルずつ塗りつぶすこともあるし、輪郭だけなぞることもある。どうアノテーションしたらいいかなどは、経験が必要になるところになるが、基本的にはそこも含めて研究要素がある。計算機に学習させるにあたっては、まずは100例くらい集め、少ないデータでも結果が出るように、画像の前処理や転移学習などを活用すると良いかもしれない。そこで、良い精度が出そうだと判断したら、必要な工夫をしながら教師データを増やし、分類器を作成し、評価する過程を繰り返すことになる。
(2)製品開発
研究開発の過程で、良い精度を確認し、学会発表や論文発表をすれば、周囲の評価や期待は大きくなるだろう。しかし、製品化するには別の難関がある。たとえば、共同研究先がA社製のCTを活用し、撮像条件も同等だった場合でも、当然その画像に特化したAIができることになる。実際はA社製の異なる品番のCTでは画像の質が異なるし、他社製、撮像プロトコルが異なれば、画像の質の違いが大きくなる。多様な画像にも有効なAIを開発するには、画像の前処理で対応したり、多様な画像を教師データに加えることでロバスト性を担保する必要がある。これらのことから、単施設との研究では限界がある場合が多く、多くの医療機関を提携したりして、多様なデータを収集する必要もある。また、既存のシステムに頼らないシステムを開発するか、難しければ既存の画像管理サーバーであるPACSなどに接続する必要があり、ベンターの協力が必要である。
(3)法規制対応
前述で述べた通り診断に寄与するソフトウェアは医療機器として認証・承認を取得しなくてはならない。申請をするためには医療機器の製造販売業等の業許可が必要である。業許可申請については、都道府県に申請することになる。また、社内で医療機器を製造できるQMS体制を構築し、運用することになる。業許可及びQMS体制がととのえば、前例となる医療機器を参照して申請ができるものなどであれば、認証機関に認証を取得することになる。前例となる医療機器がない場合は、PMDAに申請することになる。PMDAの承認を得るためには、以下のような流れがある。(1)「全般相談(相談内容をすり合わせ、相談区分を確認する。無料。目安 :相談希望日の 2週間前までに予約。)」(2)「準備面談(有料)(目安 : 相談希望日の2週間前までに予約)」(3)「RS相談(有料)」・「開発前相談(有料)」・「治験相談(有料)」「プロトコル相談(有料)」(目安 : 相談希望日の1.5–2ヶ月前までに予約)(4)申請。相談手数料について、治験相談をする場合は200万円以上かかるが、そうでなければ全体を通して100万くらいを見込んでおいた方がよい。申し込みはFAXだったり、相談資料を手持ちしたりと、人によっては慣れない対応をする必要がある。PMDAへの相談としては「こういう効果効能を謳いたい」という「クレーム」を明確化し、そのクレームに合わせて研究をデザインする必要がある。「〇〇なAIを開発したいが、どんな研究デザインなら良いか?」というような受け身な姿勢では相手にしてもらえないようにおもう。知見がなければ、類似医療機器の研究例を参考にしたり、コンサルに頼んででも良いので、「これで申請すれば十分だと思うがよいか?」と、案を示す必要がある。申請から認可が降りるまでの期間は半年から数年と、試験の新規性や複雑性によってまちまちである。また、わからないことがわからないような状態であれば、厚生労働省に新設されたMEDISO(Medical Innovation Support Office)というものがあるので、第一歩としてそちらに問い合わせるのもいいだろう。
(4)販売・保守
いよいよ認証、あるいは承認を取得したら、販売開始になる。最適な販売チャネルについては、まだまだAIソフトウェア医療機器の販売前例も少なく、悩ましいところである。既存の医療機器と親和性が高ければ、そのベンダーと販売連携をして、販売することは有力な選択肢の一つだろう。販売後も、保守をしたり、法規制対応で一部変更承認申請をして認可が取れた後は、バージョンアップすることもあるので、柔軟に対応できるシステム構成にする必要がある。また、料金も売り切りにするのか、サーバーのように数年単位の契約にするのか、あるいは月額課金にするのか、保守契約を結ぶのかなど、開発コストを含む必要な販管費を見極めながら、決める必要がある。
以上、非常に簡単ではあるが、AI・ソフトウェア医療の開発・販売までの一連の流れについて、私見を記述した。興味があるけどどう進めるかわからない方に少しでも参考になればと思う。