今月(2021年1月)、FDAより “Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD) Action Plan.” というAction Planが発表され、話題となった。ここでは、近年増加しているAIを活用した医療機器プログラムに対する課題をまとめ、そのAction Planが示されている。AIで特に問題として挙げられるのはバージョンアップについてである。現在、既存の医療機器とは比にならないほどバージョンアップの頻度が高いAIについて、新しい審査方法等が求められている。だが実際、AI医療機器プログラムおいて、バージョンアップの何が問題なのだろうか。自分事で悩んでいる人はあまりいないと思うが、この業界のプレイヤーとしてバージョンアップ問題について共有し、少しでも現状を改善していく糧になればと思い、久々にメモ程度にまとめてみようと思う。
なぜ、バージョンアップが問題なのか?
一般的に、ハードウェアを含む医療機器は性能の改善が繰り返され、改良された製品がその都度、医療機器としての認証・承認を受けて販売される。また、一部のマイナーチェンジであれば、既存の製品について“一部変更承認申請”を申請し、申請を簡略化することも可能である。 原則、医療機器メーカーは常に最新の医療機器を世の中に勝手に上市してはならず、改良する度に何らかの申請をして、承認・認証された後に上市することになる。改善から販売する間にタイムラグが発生することは、仕方がないこととして考えられてきた。それではなぜ、AI 医療機器プログラムではそれが大きな問題になるのだろうか?端的に示すと、AIの場合、医療機器承認申請をして半年後の認証・承認を受けたときには、すでにかなり古いバージョンになっているからである。AIの進化のスピードは非常に早く、深層学習のモデルだけでも毎月のように試す価値がある新しいモデルが発表されている。また、常に教師データを加えて精度を向上させたり、医師からのフィードバックを反映しながら改善を繰り返しているため、進化のスピードが非常に早い。お使いのPCやスマートフォンでも、「またバージョンアップするのか。」などと感じられる方も多いのではないだろうか。それらと同等に、AI医療機器プログラムものバージョンアップも非常に高頻度になる。日本の医療機器は”安全性”と”効果性”の両方を審査されるため、その都度、性能評価試験を求められることもある。場合によっては、医師を集ってAIの効果性について臨床試験や治験等を行い、統計的に解析して安全性・効果性の向上を評価し、再申請することが必要がある。そのため、最新のバージョンが世の中に出るまでに1年以上かかってもおかしくない。その結果、日々進化したものを世の中に出して改善し続けることができず、世界では競争力が低いAIになる環境と言わざるを得なくなる。一方で、韓国は企業の責任で適宜バージョンアップできる範囲が広く、改善のスピードは日本とは比にならないと想定される。これでは日本の国際競争力も弱くなり、バージョンアップにかかる開発コストが増大し、最終的には医療費が上がることになってしまう。我々もなるべく高品質なAIを安価に、スピーディーに提供し、世界の医療費の削減にも寄与したいのだが、そのためにもバージョンアップ問題の解決は非常に重要な課題である。
FDAはバージョンアップ問題に対するAction Planにコミットをした。
そこでFDAから発表されたAction Planは、単なる構想をかかげているだけでなく、具体的で、期限付きであるところが好感を持てるものであった。Action Plan にて
What we heard: Stakeholders provided many suggestions for further development of the proposed regulatory framework for AI/ML-based SaMD, including for the Predetermined Change Control Plan described in the discussion paper.
“Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD) Action Plan.” FDAより
What we’ll do: Update the proposed framework for AI/ML-based SaMD, including through issuance of Draft Guidance on the Predetermined Change Control Plan
Our goal is to publish this draft guidance in 2021.
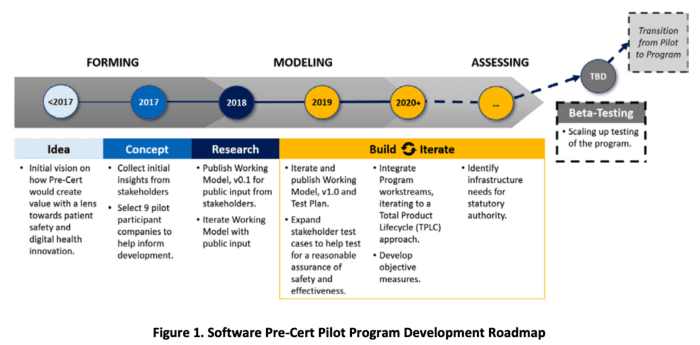
と記載がある。AIのバージョンアップ問題について、運用面も含めた具体的な方針が示されるようだ。Algorithm Change Protocolには“ACP”という略語で定義されており、今後、FDAはACPの運用方針を作成し、そのACPに準拠している範囲において企業はバージョンアップが可能になると予測される。FDAは2019年にDigital Health Software Precertification (Pre-Cert) Programmを発表し、バージョンアップ問題をはじめとするAI医療機器プログラムに関する規制の考え方を示した。特筆すべきなのは、アルゴリズムをロックしない”可変型”のプログラム医療機器に対しても考え方を示している点でる。また、Pre-Cert Pilot Programを各企業と連携して運用し、2020年9月にはDeveloping the Software Precertification Program: Summary of Learnings and Ongoing Activities: 2020 Updateにて進捗を報告しており、Roadmapも示されている(下図参照)。いずれにせよ、まだ最適解が無い医療機器プログラムだが、問題点が整備され、運用でPDCAを回しながら作成している過程にあるといえる。
韓国の先進的な取り組み
韓国では医療AIを国を上げた産業にするという方針を掲げており、非常に勢いがある。その勢いについては過去、2019年の北米放射線学会の報告記事にて記述したとおりである。韓国におけるバージョンアップは、『ビッグデータおよび人工知能(AI)技術が適用された医療機器の承認・審査ガイドライン(手引き)』(2019年10月。前回のガイドラインは2017年11月)にて詳細にまとめれられている。特筆すべき点は、すでに承認を得ている製品のバージョンアップの場合、同等製品と見なされた場合は臨床試験等は不要な点である。製品を設計変更せず、学習データの修正・追加だけで精度が向上する場合は、技術文書提出も臨床試験も免除され、迅速に最新のバージョンを販売することが可能である。最新のAIを販売し、課題について素早くバージョンアップして提供できる点において、研究開発・販売ともに非常に恵まれた環境である。
日本におけるバージョンアップ問題への課題は?
日本でも、バージョンアップ問題については議論されている。2019年薬機法改正において先駆的医療機器の開発に関わる法改正がなされた。医療機器の特性に応じた新たな承認制度として、「医療機器等の変更計画の確認及び計画に従った変更に係る事前届出制度」が導入されている。これは、改良が見込まれている医療機器について、計画された範囲の中で迅速な承認事項の一部変更を認めるもので、IDATEN(Improvement Design within Approval for Timely Evaluation and Notice)とも呼ばれている(下図参照)。
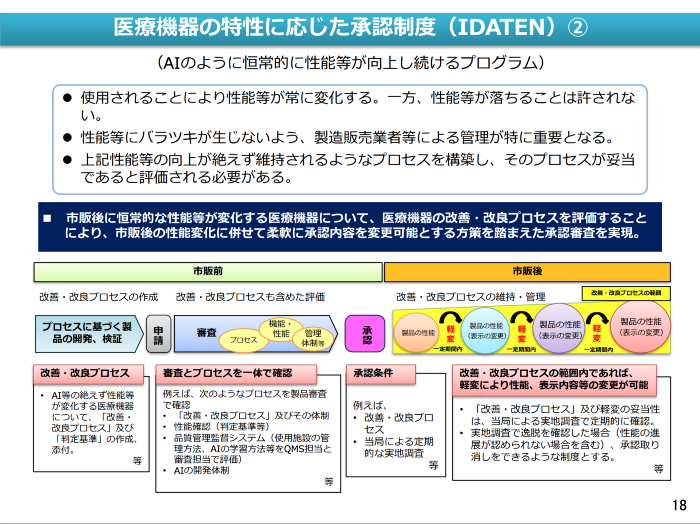
「医療機器・再生医療等製品における 承認審査の現状と規制動向」参照
性能等が落ちることは許されておらず、その性能をどのように評価すべきかについてや、具体例は示されていない。運用しながらケースバイケースで対応することになると想定され、新・制度の初期フェーズにおいてその様になることは一定は仕方がないことと理解できる。一方で、具体的なフレームワークがない中で計画し、資料が整ったところでIDATENの事前相談等に申し込むため、計画〜相談できるまでに 数か月~半年の時間が最低でもかかってしまう。このようなコストについて、現在の計画を変更してまで挑戦しにくい点がプレイヤーとしての率直な感想である。IDATENにて申請する場合、具体的に期限をつけて学習に使う枚数や精度向上の見込みを立て、改良方針を示す必要がありそうだが、承認される間にそのスケジュールすら変更される可能性もあるため、なかなか挑戦しずらい。事前相談をするだけでも書類や計画を必要とされて時間がかかるため、どのプロジェクトでこの制度に挑戦すべきかについては、社内でも頭を悩ませるところである。
今後のバージョンアップ問題についておもうこと
FDAが医療機器プログラムのバージョンアップの種類を3つに分けており、1)performance(性能)、2)inputs(学習データ)、3)intended use(使用目的)、と分けている。ここからは私見になるが、使用目的が変わる場合は、新たに申請して審査を受けることは、致し方ないと思う。一方で、一度承認されたプログラムは、使用目的が変わらない範囲において、性能の改善・教師データの追加については企業に委ねていただきたい。日々の精度改善の頻度は非常に高頻度であり、一日でも早く臨床のフィードバックを活かしたAIを世の中に届けたいと考えている。使用目的も同じで精度改善が1年以上のタイムラグが発生してしまっては、日々改善を繰り返している諸外国に非常に不利な環境となってしまう。当然、その改善のプロセスはQMS(品質管理システム)にのっとり、管理・記録しているため、その記録を定期的に審査側が監視することはあっても良いとは思う。ただ、その都度承認を得るのではなく、このように常に監視するスタイルの方が、AIには合った審査方法だと考えている。物売りの時代からサービス売の世の中と呼ばれている中、顧客接点が売って終わりではなく、常につながっている状況である現在の世の中であるのと同等に、そのほうが時代に即したプロセスなのではないだろうか。もしかすると、IDATENはまだ具体例が明示されていないが、いつか上記のような方向に改善されていくかもしれないし、そのように期待したい。いずれにしても、依然として大きな問題であるバージョンアップ問題の解決方法がクリア、かつシンプルになることを希望し、そうなるように最善を尽くしたい。その結果、多くの事業者がAI医療にとりくみ、AIが医療福祉の向上に大きく寄与する世の中になり、結果として日本もそれを先導できるよう、プレイヤーとして日々精進していきたい。